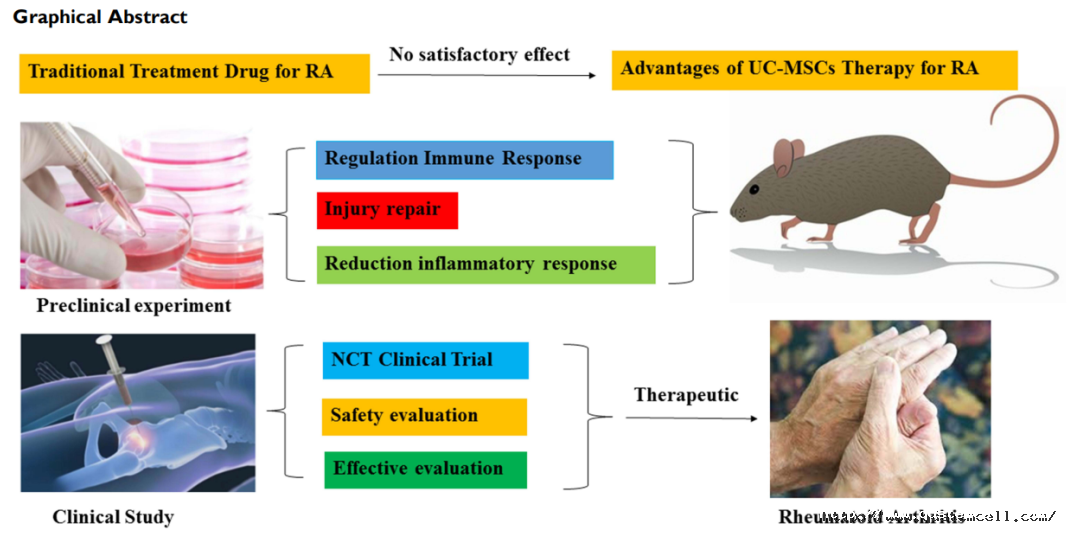
近日在《Drug Design, Development and Therapy》杂志上,发表了一篇“Umbilical Cord Mesenchymal Stem Cell Therapy for Regenerative Treatment of Rheumatoid Arthritis: Opportunities and Challenges”文章,阐述了再生医学脐带间充质干细胞治疗类风湿性关节炎所面对的机遇与挑战。

简介
类风湿性关节炎(Rheumatoid arthritis, RA)是一种系统性、炎性自身免疫性疾病,其主要病理特征是累及外周小关节病变,同时伴有关节滑膜细胞增生、炎性细胞浸润、血管翳,预后较差,可用的治疗选择有限,中位生存期仅为3 - 5年。迄今为止,传统的RA治疗主要是减少症状性炎症反应和后遗症,常规治疗已不能满足临床疗效的要求。因此,探索更有效、更安全的治疗方案变得越来越重要。

间充质干细胞(Mesenchymal stem cells, MSCs)来源于早期发育的中胚层多能干细胞,具有高度的自我更新和多向分化潜能;间充质干细胞广泛存在于各种人体组织中,可在体外培养。在特定条件下,MSCs可分化为成骨细胞、神经细胞、脂肪细胞、肌肉细胞和心肌细胞。因此,这些细胞在组织工程修复和细胞替代治疗中有很好的应用价值。
由于间充质干细胞可以分化为骨和软骨,这些细胞还能抑制免疫,缓解炎症,抵抗纤维化,促进血管修复。本文综述了脐带间充质干细胞(UC-MSCs)治疗类风湿性关节炎的临床前实验和临床研究进展,探讨了研究进展中的机遇和挑战。
类风湿性关节炎的传统治疗药物
目前治疗类风湿性关节炎的药物按照开发时间和原理分为四代: 第一代是非甾体抗炎药(NSAIDs)像阿司匹林和双氯芬酸等药物,但此类药物对关节破坏无治疗作用,主要副作用为胃肠道症状。 第二代是糖皮质激素类药物通过减少促炎细胞因子的产生,有效缓解炎症。但是,此类药物不能阻止RA的进展或关节破坏,长期使用可引起感染、皮质功能亢进、骨质疏松和高血压等副作用。 第三代是改变疾病的药物(缓效抗风湿药,SAARDs),这类药物包括抗疟药、金制剂和细胞毒性药物。主要通过减少滑膜炎症来控制关节疾病的发展,甚至起到修复作用,但这些药物大多有严重的副作用,如呕吐、皮疹、白细胞减少、肝肾功能损害等。 第四代是早期生物制剂,以肿瘤坏死因子(TNF)-α抑制剂为主,生物制剂具有药理选择性高、毒副作用低等优点,具有广阔的应用前景。在用于治疗RA的生物制剂中,临床研究最多的是TNF-α抑制剂。三种TNF-α抑制剂依那西普、英夫利昔单抗和阿达木单抗目前被批准用于治疗类风湿性关节炎。但是英夫利昔单抗,用于治疗早期RA患者,常见的不良反应是部分患者的感染和过敏反应。阿达木单抗,存在鼻咽炎、上呼吸道感染等不良反应,患者容易出现肺结核复发。这些发现在一定程度上限制了生物制剂的广泛应用。

脐带间充质干细胞(UC-MSC)治疗类风湿性关节炎(RA)的优势:
MSCs具有免疫调节作用,可调节T细胞、B细胞、树突状细胞(DCs)和自然杀伤细胞(NK)的细胞因子的表达。然而,RA主要由T细胞介导的自身免疫性疾病引起,涉及B细胞、细胞因子、凋亡、蛋白酶等因素。在大多数实验模型中,MSC治疗的有效性通过显著减少实验性关节炎的诱导和进展得到证实。 UC-MSCs具有以下优势:细胞表面主要组织相容性复合体I (major tissue compatibility complex I, MHCI)表达较低,且MHCII不表达,因此UC-MSCs很少发生免疫排斥反应。UC-MSCs的生长环境比其他MSCs更纯净,且具有更强的增殖和分化能力,易于体外培养。UC-MSCs来源于脐带,伦理问题较少,而且它们不容易传播疾病。
临床前实验
免疫调节作用
UC-MSCs通过多种途径介导T细胞亚群的分化、增殖和活化,抑制B细胞的增殖和分化,以及DCs活性的成熟和NK细胞活性,达到多种免疫调节作用。因此,UC-MSCs可能是介入RA相关炎症的病理基础的可行方法。
修复作用
UC-MSCs具有较强的增殖能力和多向性,在体内或体外适当的环境下均可分化成成体细胞。UC-MSCs具有组织修复和再生的能力。UC-MSCs分泌一系列生长因子,如肝细胞生长因子(HGF)、血管内皮生长因子(VEGF)、基质细胞源性因子-1 (SDF-1)等,以促进增殖和组织损伤修复。因此,UC-MSCs可广泛应用于关节软骨修复。
减少炎症反应
UC-MSCs在损伤部位的炎症反应中发挥作用,减轻炎症反应。UC-MSCs通过广泛下调作用于免疫细胞的炎症产物或细胞毒性介质,并提高抗炎细胞因子IL-10的水平,显著减少炎症反应。
临床研究 根据临床前研究,UC-MSCs具有很好的免疫调节能力,能够修复组织损伤。因此,临床应用细胞治疗类风湿性关节炎取得了一定的效果。许多在ClinicalTrials.gov上注册的国家临床试验(nct)见表1。
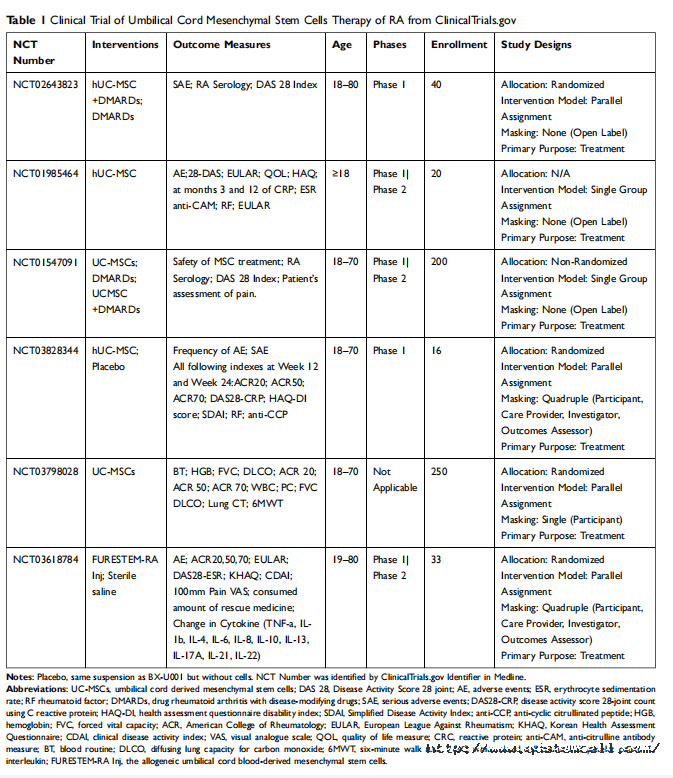
在一项多中心随机双盲平行安慰剂对照I/IIa期RA临床试验(NCT03618784)给予33例RA患者同种异体UC-MSCs (FURESTEMRA Inj)。在输注UC-MSCs后一个月监测临床和安全性参数。未观察到严重的不良事件或血清化学或血液学特征的主要异常。在RA患者中使用UC-MSCs的早期临床研究显示了很好的安全性,可以显著改善症状和修复受损组织。
对10名幼年特发性关节炎(JIA)儿童(<17岁)和64名RA患者(18-64岁)进行了前瞻性I/II期研究。患者经静脉注射40 mL UC-MSC悬浮液(2×107细胞/20 mL)。治疗后1年、3年的ESR、C反应蛋白(CRP)、类风湿因子(RF)水平以及治疗后3年的anti-CCP水平均显著低于治疗前。治疗后1年和3年,HAQ和DAS28较治疗前水平下降。
总之,UC-MSC治疗是一种安全、有效、可行的RA治疗方案。
结论: UC-MSCs在类风湿性关节炎患者中表现出良好的疗效和耐受性,已成为治疗类风湿性关节炎的一种有前景的选择。RA的发病机制与免疫机制和细胞因子紊乱有关。UC-MSCs广泛存在低免疫原性,克服了缺乏传统干细胞来源、异基因排斥和伦理等局限性。由于UC-MSCs在临床实践中取得了一定的疗效,且副作用少,值得进一步进行大样本RCT评估。 参考文献: Xiao LV, Li MW, Xiao RZ, et al. Umbilical Cord Mesenchymal Stem Cell Therapy for Regenerative Treatment of Rheumatoid Arthritis: Opportunities and Challenges. Drug Des Devel Ther. 2021 Sep 15;15:3927-3936.